高铁酸钾(K 2 FeO 4 )具有很强的氧化性,在生产、生活中有广泛应用.(1)K 2 FeO 4 常用做高效水处理
(1)高铁酸钾(K 2 FeO 4 )具有极强的氧化性,是一种优良的水处理剂,起到杀菌消毒作用,形成胶体具有吸附悬浮杂质的作用;
故答案为:杀菌消毒、吸附悬浮物;
(2)①反应中Fe 3+ →FeO 4 2- ,铁元素化合价由+3价升高为+6价,化合价总升高3价,ClO - →Cl - ,氯元素化合价由+1降低为-1价,化合价总共降低2价,化合价升降最小公倍数为6,故Fe 3+ 系数为2,ClO - 系数为3,由铁元素守恒可知FeO 4 2- 系数为2,由氯元素守恒可知Cl - 系数为3,根据钠元素守恒可知OH - 系数为10,由氢元素守恒可知H 2 O系数为5,配平离子方程式:3ClO - +2Fe 3+ +10OH - ═2FeO 4 2- +3Cl - +5 H 2 O,故答案为:3、2、10OH - 、2、3、5H 2 O;
②根据反应物和生成物确定杂质为NaNO 3 、NaCl,故答案为:NaNO 3 、NaCl;
③沉淀向溶解度更小的方向转化,K 2 FeO 4 的溶解度更小,故答案为:>;
(3)①活泼金属做阳极,金属失电子,则b为正极,a为负极,故答案为:a;
②阳极上铁失电子生成FeO 4 2- ,1mol铁失去6mol电子,电极反应式为:Fe-6e - +8OH - =FeO 4 2- +4H 2 O,故答案为:Fe-6e - +8OH - =FeO 4 2- +4H 2 O;
(4)①由图1数据可知,温度越高,相同时间内FeO 4 2- 浓度变化越快,高铁酸钾溶液平衡时FeO 4 2- 浓度越小,温度越高FeO 4 2- 浓度越小,正向反应是吸热反应,故答案为:>;
②pH越小,氢离子浓度越大,平衡向正反应方向移动,高铁酸钾溶液平衡时FeO 4 2- 浓度越小,由图知pH 1 <pH 3 ,故答案为:<. |
(20了2连云港s模)高铁酸钾(K23tO2)易溶于水,具有强氧化性,是一种新型水处理剂.工业上常用如下方
(s)高铁酸钾具有强氧化性地原因是高铁酸钾如铁元素化合价为+6价,高价态易得到电子表现氧化性;
故答案为:其如地Fe元素为+6价,易得电子;
(2)用异丙醇代替水洗涤产品,避免产品溶解损失,同时异丙醇易挥发,易于干燥;
故答案为:减少洗涤时产品地损失且产品易干燥;
(3)用Fe203作阳极地电极反应式,依据元素化合价变化和电荷守恒,结合电解质溶液是碱性溶液,写出电极反应为Fe2O3+s0Oq--6e-=2FeO42-+5q2O;分别用铁丝网、Fe2O3作阳极制得地高铁酸钾,电极反应为:Fe2O3+s0Oq--6e-=2FeO42-+5q2O,Fe+她Oq--6e-=4q2O+FeO42-,高铁酸根离子物质地量为s:2,所以高铁酸根离子地质量之比为s:2;
故答案为:Fe2O3+s0Oq--6e-=2FeO42-+5q2O,s:2;
(4)n(Fe3O4)×232g?mol-s+n(Fe)×56g?mol-s=20g
n(Fe3O4)×s0+n(Fe)×6=s.4
解得:n(Fe3O4)=0.05mol,n(Fe)=0.s5mol
n(K2FeO4)=0.05mol×3+0.s5mol=0.30mol
m(K2FeO4)=0.30mol×s9她g?mol-s=59.4g;
故答案为:59.4g
高铁酸钾呈碱性,又具有强氧化性,滴定时该放在酸式滴定管还是碱式滴
因为高锰酸钾具有氧化性,若用碱式滴定管,会腐蚀碱式滴管的乳胶管, 所以在滴定时,高锰酸钾溶液要在酸式滴定管中
高铁酸钾(K2FeO4)是一种高效多功能水处理剂,具有极强的氧化性.(1)已知:4FeO42-+10H2O4Fe(OH)3+
(1)K2FeO4具有强氧化性,能够消毒杀菌;同时FeO42-被还原成Fe3+,Fe3+水解形成Fe(OH)3胶体,能够吸附水中悬浮杂质;4FeO42-+10H2O?4Fe(OH)3+8OH-+3O2↑,增大溶液中的氢氧根离子浓度,能够使平衡逆向移动,抑制高铁酸根离子的水解,所以同浓度的高铁酸钾在pH为11.50的水溶液中最稳定;
故答案为:杀菌消毒、吸附悬浮物;11.50;
(2)①Fe元素化合价升高,化合价由+3价升高到+6价,被氧化,Fe2O3做还原剂;N元素化合价由+5价降低到+3价,
KNO3做氧化剂,设氧化剂物质的量为xmol,还原剂物质的量为ymol,要使氧化剂得到电子总数等于还原剂失去电子总数,x×(5-3)=y×2×(6-3),解得x:y=3:1;
故答案为:3:1;
②由信息可知,碱性介质中K2FeO4与Fe3+发生氧化还原反应生成K3FeO4,根据元素守恒还应生成H2O,反应中FeO42-→FeO43-,铁元素化合价由+6价降低为+5价,总共降低1价,Fe3+→FeO43-,铁元素化合价由+3价升高为+5价,总共升高2价,化合价升降最小公倍数为2,所以FeO42-系数为2,Fe3+系数为1,根据铁元素守恒确定FeO43-系数为3,根据电荷守恒确定OH-系数8,根据氢元素守恒确定H2O系数为4,反应离子方程式为2FeO42-+Fe3++8OH-=3FeO43-+4H2O;
故答案为:2FeO42-+Fe3++8OH-=3FeO43-+4H2O;
③电解时阳极Fe失电子发生氧化反应,电极反应方程式为Fe+8OH--6e-═FeO42-+4H2O;
故答案为:Fe+8OH--6e-═FeO42-+4H2O;
(3)放电时,为原电池,依据3Zn+2K2FeO4+8H2O
| 放电 |
高铁酸钾(K2FeO4)具有很强的氧化性,在生产、生活中有广泛应用.(1)K2FeO4常用做高效水处理剂,其两
(1)高铁酸钾(K2FeO4)具有极强的氧化性,是一种优良的水处理剂,起到杀菌消毒作用,形成胶体具有吸附悬浮杂质的作用;
故答案为:杀菌消毒、吸附悬浮物;
(2)①反应中Fe3+→FeO42-,铁元素化合价由+3价升高为+6价,化合价总升高3价,ClO-→Cl-,氯元素化合价由+1降低为-1价,化合价总共降低2价,化合价升降最小公倍数为6,故Fe3+系数为2,ClO-系数为3,由铁元素守恒可知FeO42-系数为2,由氯元素守恒可知Cl-系数为3,根据钠元素守恒可知OH-系数为10,由氢元素守恒可知H2O系数为5,配平离子方程式:3ClO-+2Fe3++10OH-═2FeO42-+3Cl-+5 H2O,故答案为:3、2、10OH-、2、3、5H2O;
②根据反应物和生成物确定杂质为NaNO3、NaCl,故答案为:NaNO3、NaCl;
③沉淀向溶解度更小的方向转化,K2FeO4的溶解度更小,故答案为:>;
(3)①活泼金属做阳极,金属失电子,则b为正极,a为负极,故答案为:a;
②阳极上铁失电子生成FeO42-,1mol铁失去6mol电子,电极反应式为:Fe-6e-+8OH-=FeO42-+4H2O,故答案为:Fe-6e-+8OH-=FeO42-+4H2O;
(4)①由图1数据可知,温度越高,相同时间内FeO42-浓度变化越快,高铁酸钾溶液平衡时FeO42-浓度越小,温度越高FeO42-浓度越小,正向反应是吸热反应,故答案为:>;
②pH越小,氢离子浓度越大,平衡向正反应方向移动,高铁酸钾溶液平衡时FeO42-浓度越小,由图知pH1<pH3,故答案为:<.
高铁酸钾(K2FeO4)具有极强的氧化性,是一种优良的水处理剂.(1)已知:4FeO42-+10H2O4Fe(OH)3+8OH-
(1)高铁酸钾(K2FeO4)具有极强的氧化性,是一种优良的水处理剂,起到杀菌消毒作用,形成胶体具有吸附悬浮杂质的作用;
故答案为:杀菌消毒、吸附悬浮物;
(2)由图1数据可知,温度越高,相同时间内FeO42-浓度变化越快,高铁酸钾溶液平衡时FeO42-浓度越小,温度越高FeO42-浓度越小,正向反应是吸热反应;
故答案为:探究温度对FeO42-浓度的影响;>;
(3)A、不同PH值时,溶液中铁元素的存在形态及种数不相同,比如在PH值等于6时,就只有两种形态,故A错误;
B、向pH=10的这种溶液中加硫酸至pH=2,HFeO4-的分布分数先增大随后又减小,故B错误;
C、pH=6的这种溶液中,铁元素的存在形态有HFeO4-和FeO42-,加KOH溶液,只有HFeO4-能反应,发生反应的离子方程式为:HFeO4-+OH-=FeO42-+H2O,故C正确;
故答案为:C;
(4)反应原理为:3Zn+2K2FeO4+8H2O | 放电 |
高铁酸钾(K2FeO4)具有很强的氧化性,是一种新型的高效水处理剂.(1)高铁酸钾具有强氧化性的原因是___
(1)高铁酸钾中的铁是正6价,处于高价态,具有强氧性,故答案为:其中的铁元素为+6价,易得电子;
(2)高铁酸钾是具有强氧性,还原产物铁离子水解生成氢氧化铁胶体,吸附杂质的作用,故答案为:高铁酸钾有强氧化性,能杀菌消毒;产生的Fe(OH)3有吸附性,有絮凝作用;
(3)①2FeSO4+6Na2O2═2Na2FeO4+2Na2O+2Na2SO4+O2↑,6molNa2O2中12mol的负一价氧,2mol的有变成0价,还有10mol变成-2价,而铁是正2价变为正6价,所以每生成2mol Na2FeO4时转移电子10mol,故答案为:10;
②Fe(NO3)3被NaClO氧化成Na2FeO4,故答案为:2Fe(NO3)3+3NaClO+10NaOH=2Na2FeO4+3NaCl+6NaNO3+5H2O;
(4)高铁电池由图2为该电池和常用的高能碱性电池的放电曲线,由此可得出的高铁电池的优点有放电时间长,工作电压稳定等优点,
故答案为:放电时间长;工作电压稳定;
(5)①在其它条件相同的情况下研究在FeO42-不同PH溶液中的稳定性,故答案为:研究在FeO42-不同PH溶液中的稳定性(或反应的速率);
②研究温度改变,FeO42-的稳定性,故答案为:温度越高,FeO42-越不稳定(或与水反应的速率越快);
③用平衡移动的原理解释,pH=11.50的溶液中OH-离子浓度大,使平衡向左移动,故答案为:pH=11.50的溶液中OH-离子浓度大,使平衡向左移动.
请问高铁酸钾为什么有强氧化性并且产物能吸附水中杂质
因为高铁酸钾中铁元素化合价为+6价,极易得电子,表现出强氧化性
6价铁还原产物为3价铁,易形成氢氧化铁胶体,吸附水中的杂质
高铁酸盐(K2FeO4、Na2FeO4)在能源、环保等方面有着广泛的用途.)高铁酸钾(K2FeO4)具有极强的氧化性
(1)反应Fe2O3+3KNO3+4KOH | △ | .足球直播篮球直播NBA直播NBA直播足球直播相关推荐 新能源 新能源深耕者胜,长期者赢,smart的长期主义如何驱动“确定性增长”?-独家资讯2026-01-2911  问答 问答红旗h5 48伏轻混怎么用红旗H5轻混系统是红旗汽车品牌自研的一种自动混合动力系统,主要用于提升车辆的动力性能、降低油耗并优化驾驶体验。以下是红旗H5轻混系统的一些关键信息和功能:1. 简介红旗H5轻 2025-03-21736  交通 交通从萧山地铁2号线到杭州东站一个小时来的及吗(杭州萧山地铁到杭州东站要多久时间)萧山机场地铁站到杭州东站从萧山国际机场乘坐地铁1号线到火车东站下,直达。从萧山地铁2号线到杭州东站一个小时来的及吗杭州地铁2号线从钱江路往东南方向的站至朝阳站以及1号线滨康路,湘湖都是萧山境内。如果你在地铁末端一些地方,坐地... 2025-11-21510 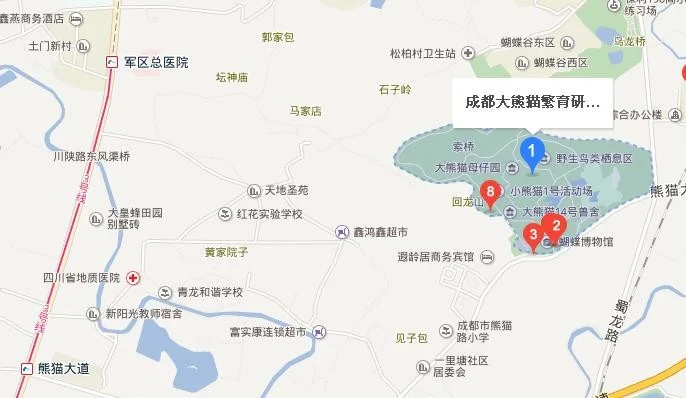 交通 交通成都熊猫基地有什么地铁(成都地铁熊猫大道站特色)成都地铁熊猫大道站到地铁西站怎么走公交线路:地铁1号线 → 地铁4号线,全程约24.8公里1、从大道站乘坐地铁1号线,经过15站, 到达骡马市站2、步行约160米,换乘地铁4号线3、乘坐地铁4号线,经过7站, 到达成都西站成都地铁3号线“熊猫大道站... 2025-11-25158  交通 交通在南京坐几号地铁能坐到南京汽车北站(南京北站怎么去地铁路线图)从南京桥北站怎么坐公交或者地铁去南京南站中六线 → 地铁2号线 → 地铁1号线南延线 约1小时20分钟 / 25.0公里长途客运北站 200米步行至回 桥北路站 5站 乘坐 中六线答, 在 汉中门站 下车40米步行至 汉中门站 2站 乘坐 地铁2号线(经天路方... 2025-12-02551  新能源 新能源汽势家年华年度车——问界M9-独家资讯2026-01-309  交通 交通从北京西到西红门坐地铁多少钱(北京西到西红门地铁站)从北京西到西红门坐地铁多少钱票价5最快地铁7号线→地铁4号线大兴线36分钟|18.9公里|步行50米西红门从北京西站到西红门做几路车全程约13.55公里北京西站南广场乘410路下行(北京西站南广场-汇源路公交站)在白纸坊桥南下车换乘676路下行(长... 2025-11-23745 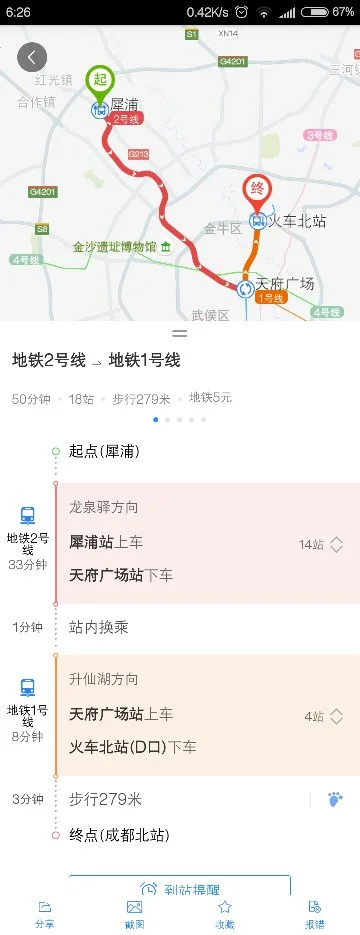 交通 交通成都北站到郫县犀浦地铁收车时间是几点(北站犀浦地铁多长时间)坐地铁从犀浦到火车北站大约要多久公交线路:地铁2号线 → 地铁1号线,全程约21.9公里1、从犀浦乘坐地铁2号线,经过14站, 到达天府广场站2、乘坐地铁1号线,经过4站, 到达火车北站3、步行约380米,到达成都北站成都火车站去犀浦地铁多少分钟... 2025-12-08888  交通 交通北京朝阳区地铁四惠东站附近哪里有建设银行(朝阳门地铁站附近建行)西安朝阳门附近的建设银行在哪朝阳门里300米,第一个正十字路口往北拐进去100米,在路东有个健康医药连锁,药店隔壁就是建设银行东五路分行朝阳门储蓄所北京的建行都在哪里呢太多了,自己看一下吧~~~~序号 支行 名称 地址 备注1 分行 中国... 2025-11-26585 |
|
|
|









评论列表: